что такое серная кислота для чего используется
Серная кислота
Концентрированная серная кислота очень бурно реагирует с водой, так как при этом выделяется большое количество тепла (19 ккал на моль кислоты) вследствие образования гидратов. По этой причине следует всегда разбавлять серную кислоту, наливая её в воду, а не наоборот.
Серная кислота обладает высокой гигроскопичностью, то есть хорошо поглощает водные пары из воздуха, поэтому может применяться для осушения газов, не реагирующих с нею. Гигроскопичностью обьясняется и обугливание органических веществ, к примеру, сахара или дерева, при воздействии на них концентрированной серной кислотой. При этом образуются гидраты серной кислоты. Также из-за малой летучести её используют для вытеснения других, более летучих кислот из их солей.
Концентрированная серная кислота является сильным окислителем. Она окисляет металлы, стоящие в ряду напряжений до серебра включительно, а продукты реакции зависят от условий ее проведения и активности самого металла. Образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры.
Разбавленная серная кислота взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода (H), с выделением Н2, окислительные свойства для нее нехарактерны.
В промышленности серная кислота получают двумя методами: контактный метод с использованием твердых катализаторов (контактов), и нитрозный — с оксидами азота. Сырьём служат сера, сульфиды металлов и т.п. Выпускается кислота нескольких сортов, в зависимости от чистоты и концентрации: аккумуляторная(самая чистая), техническая,башенная, купоросное масло, олеум(раствор серного ангидрида в серной кислоте).
Применение серной кислоты:
Применение серной кислоты в промышленности
Пищевая промышленность знакома с серной кислотой в виде пищевой добавки Е513. Кислота выступает в качестве эмульгатора. Данная пищевая добавка используется для изготовления напитков. С её помощью регулируется кислотность. Помимо пищи, Е513 входит в состав минеральных удобрений. Применение серной кислоты в промышленности имеет широкое распространение. Промышленный органический синтез использует серную кислоту для проведения следующих реакций: алкилирование, дегидратация, гидратация. С помощью данной кислоты восстанавливается необходимое количество смол на фильтрах, что используются на производстве дистилированной воды.
Применение серной кислоты в быту
Серная кислота в домашних условиях пользуется спросом среди автолюбителей. Процесс приготовления раствора электролита для автомобильного аккумулятора сопровождается добавление серной кислоты. Работая с данной кислотой следует помнить о правилах безопасности. В случае попадания кислоты на одежду или открытые участки кожи, стоит немедленно промыть их проточной водой. Серная кислота, которая разлилась на металл, может нейтрализоваться с помощью извести или мела. Заправляя автомобильный аккумулятор необходимо придерживаться некой последовательности: постепенно добавлять кислоту к воде, а не наоборот. Когда вода вступает в реакцию с серной кислотой происходит сильное нагревание жидкости, что может приводить к её разбрызгиванию. Поэтому стоит быть особо внимательным, чтобы жидкость не попала на лицо, или в глаза. Кислота должна храниться в плотно закрытой емкости. Важно, чтобы химическое вещество сохранялось в недоступном для детей месте.
Применение серной кислоты в медицине
В медицине нашлось широкое применение солей серной кислоты. К примеру, магний сульфат назначается людям с целью достичь слабительного эффекта. Еще одним производным серной кислоты есть натрий тиосульфат. Лекарственное средство используется в роли противоядия в случае отправления следующими веществами: ртуть, свинец, галогены, цианид. Тиосульфат натрий вместе с соляной кислотой используется для лечения дерматологических заболеваний. Профессор Демьянович предложил союз этих двух препаратов для лечения чесотки. В виде водного раствора, натрий тиосульфат вводят людям, которые страдают аллергическими недугами.
Магния сульфат обладает широким спектром возможностей. Поэтому применяется врачами различных специальностей. В качестве спазмолитика магний сульфат вводят больным при гипертонической болезни. Если у человека присутствуют заболевания желчного пузыря, вещество вводится внутрь для улучшение желчеотделения. Применение серной кислоты в медицине в виде магния сульфата в гинекологической практике встречается часто. Гинекологи помогают роженицам посредством введения магния сульфата внутримышечно, таким способом они обезболивают роды. Помимо всех выше указанных свойств, магний сульфат обладает антисудорожным эффектом.
Применение серной кислоты в производстве
Серная кислота, области применение которой разнообразны, используется так же при производстве минеральных удобрений. Для более удобного сотрудничества, заводы,что занимаются производством серной кислоты и минеральных удобрений, в основном, расположены поблизости друг от друга. Этот момент создает непрерывное производство.
Применение серной кислоты в изготовлении красителей и синтетических волокон занимает второе место по распространенности после производства минеральных удобрений. Многие отрасли промышленности используют серную кислоту в некоторых процессах на производстве. Применение серной кислоты нашло спрос и в быту. Люди пользуются химическим веществом для обслуживания своих автомобилей. Приобрести серную кислоту возможно в магазинах, что имеют специализацию по продаже химических веществ, в том числе у нас по ссылке. Серная кислота транспортируется соответственно правилам перевозки подобного груза. Железнодорожный или автомобильный транспорт перевозит кислоту в соответствующих емкостях. В первом случае в качестве емкости выступает цистерна, во втором – бочка или контейнер.
Особенности применения и биологическая опасность
Не нашли что искали? Вы можете оставить заявку, в форме обратной связи.
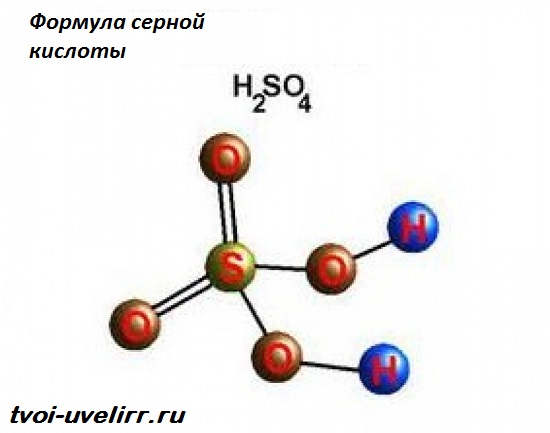
Все что необходимо знать о серной кислоте(H2SO4)
Характеристика

Основное свойство H2SO4 – гигроскопичность, поэтому её часто используют для поглощения влаги из воздуха. В течение этого процесса также происходит выделение тепла. Температура кипения зависит от степени насыщенности. При 98%-ой концентрации, достигается максимум, который составляет 330 °C, при этом возникает распад на H2O и SO3. Температура плавления – 10,38 °C, плотность – 1,84 г/см3.
Состояние жидкости влияет на то, как она изменяет другие элементы при взаимодействии с ними. Все металлы, стоящие в электрохимическом ряду активности, включая серебро, поддаются окислению при 100%-ой концентрации. Разбавленная H2SO4 окисляет все металлы, находящиеся в электрохимическом ряду активности левее водорода, однако платина и золото не состоят в этом списке.
Наблюдаются изменения при взаимодействии с органическими соединениями и неметаллами, итогом которого становится преобразование некоторых из них в уголь. H2SO4 способна растворять SO3, образуя олеум.
Классификация
H2SO4 выше 40% называется концентрированной. Она известна как сильный окислитель и при контакте с серебром или палладием растворяет их. Во время нагревания демонстрирует окислительно-восстановительные качества. Концентрация разбавленных растворов не превышает 40%. Они отличаются меньшей активностью и способны взаимодействовать с медью и латунью.
Чтобы преобразовать концентрированную смесь в разбавленную, более тяжёлую жидкость нужно смешать с H2O. Важно добавлять именно кислоту в воду, соблюдая осторожность. Если сделать наоборот, образуется кипение и токсикологические брызги.
Технологии получения

Традиционными методами, используемыми в промышленности, выступают контактный и нитрозный.
Контактный метод
Нитрозный метод
Нитрозная технология бывает двух видов: камерная и башенная. Преимущества данного подхода состоят в том, что он не требует больших денежных затрат или сложного технологичного оборудования, а также гарантирует переработку диоксида серы.
Но имеются и минусы. В конечном итоге производитель получает 75%-ую концентрацию, которая заметно уступает по качеству тому, что выходит при контактном способе. В составе наблюдается содержание оксида азота, железа и иных примесей. Возврат оксидов азота осуществляется не полностью. Нитрозный способ вреден для экологии, поскольку допускает значительные выбросы токсинов в атмосферу. Тем не менее, этот подход всё равно остаётся довольно-таки популярным.
Исходный материал – сернистый газ. Его преобразование в H2SО4 осуществляется в процессе окислительной реакции с двуокисью серы и присоединения воды. Нитрозная техника не обходится без добавления окислов азота, поскольку двуокись серы не вступает в прямой контакт с кислородом. В течение данного процесса высшие окислы азота превращаются в окись азота NO. Позднее окись азота NO снов окисляется кислородом, преобразуясь в высшие окислы.
В каких отраслях находит применение
Это далеко не все области применения. Вещество выполняет функции эмульгатора при приготовлении пищевой продукции, помогает эффективно устранять отходы в воде. Считается действительно необходимым компонентом в индустрии, замену которой трудно найти. Говоря об этом продукте, Дмитрий Менделеев отмечал, как часто к его помощи прибегают в техническом производстве, и что без него невозможно и невыгодно заниматься приготовлением других веществ.
Соли серной кислоты и область их применения
История изучения
Начало исследований было заложено ещё в Древней Греции, когда учёные заинтересовались происхождением медного купороса и его особенностями. Купорос находил применение как в медицинской практике, так и в металлургии. Первые достижения датируются XIII веком. Согласно записям алхимиков того периода для этого прибегли к нагреванию алюмокалиевых квасцов. Изучив природу квасцов, в XV веке учёные смогли приступить к следующей стадии опытов. Чуть позже, во времена Средневековья в Европе, вещество было известно как «купоросное масло», однако название было изменено на привычную современным людям «кислоту».
Следом за Джошуа к производству приступил Джон Робак из Англии, несколько адаптировав технику. Вместо стеклянных резервуаров он взял освинцованные камеры крупного размера, поскольку они были дешевле. Нововведения Робака позволяли получить 65%-ный раствор. Приёмы англичанина сохраняли популярность в течение двухсот лет. 78%-ая концентрация появилась благодаря химикам из Англии и Франции Гловеру и Гей-Люссаку. В отличие от прошлого варианта этот оказался неподходящим для создания красителей.
Новые техники были разработаны в начале XIX века. На первых порах для этого брали азот, такой способ вскоре стал именоваться «нитрозным». Также для быстрого протекания реакции обращались к платине. Только в тридцатые годы XIX века Перегрином Филипсом был запатентован экономичный путь обработки оксида серы (VI) и концентрированного раствора. А в 1864 году был запущен выпуск природных фосфорных удобрений.
К концу 1800-х годов европейские страны наладили выпуск продукции в количестве до одного миллиона тонн, а лидирующие позиции в поставке заняли Англия и Германия. На их долю приходился 71% от общего объёма. В России корпорации подобного рода открылись после 1805 года в Москве.
Производство в России
Особенности транспортировки
При транзите следует соблюдать осторожность из-за резких ядовитых свойств продукта. Он взрывоопасен и относится к восьмому классу опасности, который включает ядовитые и коррозионные грузы. Допущение перевозчиком грубых ошибок при транспортировке, ставит под угрозу не только людей, но и экологию.
Перевозка происходит при соблюдении правил, гарантирующих безопасность населения. Требуется подобрать устойчивую ёмкость для транзита. Цистерны должны быть изготовлены из сплавов, которые не разрушатся под воздействием ядов. Для перевозки опасных токсинов подойдут сернокислотные химические резервуары. При необходимости поддерживать температуру, как с дымящейся жидкостью, подбираются цистерны-термосы. Для обычного груза подойдёт сернокислотная канистра.
Транспортировка допускается лишь на автомобилях со специальной маркировкой, предупреждающей об опасном грузе. Перевозить цистерны имеют право водители, получившие свидетельство АДР, подтверждающее их компетентность. Они не ограничены во времени при перевозке, поскольку обязаны соблюдать скоростной режим для исключения возможности попадания в аварию. Чтобы избежать ситуаций, создающих угрозу жизни населения, водитель должен ехать по специально-разработанному маршруту, исключающему места большого скопления людей и производственные объекты.
Вред для человеческого здоровья
Токсичная жидкость угрожает здоровью человека не только из-за риска попадания капель на кожные ткани, она может нанести вред внутренним органам поскольку в её состав входит не менее едкий сернистый газ. Ей характерна чрезвычайная агрессивность, а входящий в состав мышьяк усиливает признаки отравления. Безвредной дозой содержания H2SО4 в воздухе считается 0,3 мг на 1 кв. м.
Признаки отравления
Первая помощь и лечение
При контакте с серной кислотой важно в первую очередь вызвать скорую помощь. До того как приедут врачи, пострадавший может самостоятельно облегчить своё состояние. Если химический продукт попал внутрь, нужно промыть желудок тёплой водой, а затем выпить 100 г оливкового или подсолнечного масла маленькими глотками. Для большей пользы можно проглотить немного льда или выпить молока. Это поможет снизить содержание H2SО4.
Если жидкость попала на слизистую оболочку глаз, необходимо промыть их проточной водой. До прибытия скорой помощи в глаза следует закапать раствор новокаина и дикаина. При отравлении парами постращавшему требуется срочно выйти на свежий воздух и промыть слизистые оболочки водой. Чтобы уменьшить площадь повреждения тканей, обожжённый участок кожи нужно промыть проточной водой и приложить повязку с содой.
Если у больного наблюдается желудочное кровотечение, ему необходимо переливание крови и также введение плазмы. В ряде случаев при кровотечении может понадобиться хирургическое вмешательство.
Интересные факты о серной кислоте
Хотя сегодня принято изготавливать серную кислоту на специальных предприятиях, она всё же встречается в природе, причём в 100%-ом виде. Например, в Италии на острове Сицилия можно увидеть, как со дна Мёртвого моря просачивается H2SО4. Это место принято называть Озером смерти, живые существа стараются не подходить слишком близко к нему. Выделение серной кислоты со дна происходит из-за содержания в земной коре пирита.
Серная кислота может выделяться и при сильных извержениях вулкана. Такие явления достаточно опасны для людей и окружающей среды. Одними из последствий попадания H2SО4 в атмосферу могут стать климатические изменения. Серная кислота считается главной причиной, по которой выпадают кислотные дожди, а выделяется она из-за попадания в воздух диоксида серы.
Как уже было ранее замечено, серная кислота эффективно поглощает воду из воздуха. Это качество позволяет использовать её для осушения газов. Раньше было принято наливать жидкость в небольшие ёмкости и оставлять между стёклами. Это помогало предотвратить запотевание окон в комнате.
Серная кислота. Свойства, добыча, применение и цена серной кислоты
В городе Ревда с рельсов сошли 15 вагонов с серной кислотой. Груз принадлежал Среднеуральскому медеплавильному заводу.
ЧП произошло на ведомственных железнодорожных путях в 2013-ом году. Кислота разлилась на площади в 1000 квадратных километров.
Это указывает на масштабы потребности промышленников в реагенте. В Средние века, к примеру, в год требовались лишь десятки литров серной кислоты.
В 21-ом же веке мировая выработка вещества в год – десятки миллионов тонн. По объему производства и применения судят о развитии химических отраслей стран. Так что, реагент достоин внимания. Описание начнем со свойств вещества.
Свойства серной кислоты
Внешне 100-процентная серная кислота – маслянистая жидкость. Она бесцветна и тяжела, отличается крайней гигроскопичностью.
Это значит, что вещество поглощает из атмосферы пары воды. При этом, кислота выделяет тепло.
Поэтому, к концентрированной форме вещества воду добавляют малыми дозами. Влей много и быстро, полетят брызги кислоты.
Учитывая ее свойство разъедать материи, в том числе, и живые ткани, ситуация опасна.
Раствор серной кислоты до 40% — неконцентрированный, химически проявляет себя иначе. Воду в него доливать можно достаточно быстро.
Насыщенное же вещество взаимодействует и с неактивными. Исключение – благородные металлы. Почему же концентрат не «трогает» железо, медь?
Причина в их пассивации. Так называют процесс покрытия металлов защитной пленкой оксидов.
Она-то и препятствует растворению поверхностей, правда, лишь в обычных условиях. При нагреве реакция возможна.
Разбавленная серная кислота больше похожа на воду, нежели масло. Концентрат же, отличим не только по тягучести и плотности, но и дыму, исходящему от вещества на воздухе.
К сожалению, в Мертвом озере на Сицилии содержание кислоты меньше 40%. По внешнему виду водоема не скажешь, что он опасен.
Учитывая разъедающую способность водоема, местные преступники взялись сбрасывать в него трупы. Несколько дней, и от органики не остается и следа.
Качество горючего получаемого из обработанной органики низкое. Кислота в реакции является окислителем, хотя, может быть и восстановителем.
В последней роли вещество выступает, к примеру, взаимодействуя с галогенами. Это элементы 17-ой группы таблицы Менделеева.
Все эти вещества сами не являются сильными восстановителями. Если же кислота встречается с таковыми, выступает лишь в роли окислителя.
Пример: — реакция с сероводородом. А какие реакции дают саму серную кислоту, как ее добывают и производят?
Добыча серной кислоты
В прошлые века реагент добывали не только из железной руды, называемой пиритом, но и из железного купороса, а так же, квасцов.
В принципе, все перечисленные минералы являются серосодержащим сырьем, поэтому, могут применяться для производства серной кислоты и в современности.
Минеральная основа бывает разной, но итог ее обработки один – серный ангидрит с формулой SO2. Образуется при реакции серы с кислородом. Получается, нужно сжечь основу.
В обычных условиях сернистый ангидрид с ним взаимодействует медленно. Поэтому, промышленники окисляют сырье на катализаторах.
Однако, за последний метод «голосуют» лишь 20% промышленников. Основная же масса серной кислоты получается по контактной схеме.
Если подсчитать практику человечества по получению серной кислоты, «накапает» более 1000 лет.
Первые упоминания о реагенте и его добыче содержит труд, датируемый 940-ым годом.
Это записи одного из персидских алхимиков по имени Абубекер аль-Рази. Однако, о кислых газах, получаемых путем прокаливания квасцов, говорил и Джафар аль-Суфи.
Этот арабский алхимик жил еще в 8-ом веке. Однако, судя по записям, в чистом виде серную кислоту не получил.
Применение серной кислоты
Более 40% кислоты идут на производство минеральных удобрений. В ходу суперфосфат, сульфат аммония, аммофос.
Все это комплексные подкормки, на которые делают ставки фермеры и крупные производители.
В удобрения добавляют моногидрат. Это чистая, 100-процентная кислота. Кристаллизуется уже при 10 градусах Цельсия.
На производство всего одной тонны удобрения уходят 600 кило концентрата кислоты.
Около 30% серной кислоты тратятся на очистку углеводородов. Реагент улучшает качество смазочных масел, керосина, парафина.
К ним примыкают минеральные масла и жиры. Их тоже очищают с помощью серного концентрата.
Способность реагента растворять металлы применяется при переработке руд. Их разложение столь же бюджетно, как и сама кислота.
В главе «Свойства» указывалось, что при нагреве серная кислота справляется с оксидными пленками на латуни, меди, железе.
Поэтому, горячий реагент используют для их травления. Так именуют очистку металлических поверхностей. После обработки, сплавы и изделия из них выглядят как новые.
Способность кислоты поглощать воду из атмосферы, делает реагент отличным осушителем.
Если воздействовать на воздух 95-процентным раствором, остаточная влажность составит всего 0,003 миллиграмма паров воды на литр осушаемого газа. Метод применяют в лабораториях и на промышленных производствах.
Стоит отметить роль не только чистого вещества, но и его соединений. Они пригождаются, в основном, в медицине.
Бариевая каша, к примеру, задерживает рентгеновское излучение. Врачи заполняют веществом полые органы, облегчая исследования рентгенологов. Формула бариевой каши: — BaSO4.
Необходим минерал и строителям, использующим его в качестве связующего, скрепляющего материала, а так же, для декоративной отделки.
Цена серной кислоты
Цена на реагент – одна из причин его популярности. Килограмм технической серной кислоты можно приобрести всего за 7 рублей.
Столько за свою продукцию просят, к примеру, менеджеры одного из предприятий Ростова на Дону. Разливают канистрами по 37 кило.
Это стандартный объем тары. Встречаются, так же, канистры в 35 и 36 килограммов.
Купить серную кислоту специализированного плана, к примеру, аккумуляторную, немногим дороже.
За 36-килограммовую канистру просят, как правило, от 2000 рублей. Вот, кстати, еще одна сфера применения реагента.
Не секрет, что разбавленная дистиллированной водой кислота – это электролит. Он нужен не только для обычных батареек, но и машинных аккумуляторов.
Разряжаются они, поскольку серная кислота расходуется, при этом, выделяется более легкая вода. Падает плотность электролита, а значит, и его эффективность.