что делают с азотной кислотой
Азотная кислота. Свойства, добыча, применение и цена азотной кислоты
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.
Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2.
Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.
Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.
Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя.
В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.
Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Азотная кислота
Азотная кислота – важный, но опасный химический реактив
Современная химия насчитывает огромное количество химических реактивов: щелочи, кислоты, реагенты, соли и другие. Среди них кислоты – самая распространенная группа. Кислоты – это сложные водородосодержащие соединения, атомы которых могут замещаться атомами металла. Сфера их применения обширна. Она охватывает многие отрасли производства: химическую, машиностроительную, нефтеперерабатывающую, пищевую, а также медицину, фармакологию, косметологию; широко используется в быту.
Азотная кислота и ее определение

Форма выпуска азотной кислоты зависит от ее концентрации:
— обычная – 65 %, 68 %;
— дымная – 86 % и более. Цвет «дыма» может быть белым, если концентрация составляет от 86 % до 95 %, или красным – свыше 95 %.
В настоящее время производство сильно- или слабоконцентрированной азотной кислоты проходит следующие этапы:
1. процесс каталитического окисления синтетического аммиака;
2. как результат – получение смеси нитрозных газов;
3. впитывания воды;
4. процесс концентрирования азотной кислоты.
Хранение и транспортировка
— каждая тара помечается надписью «Опасно».
Где применяется химический реактив?
Сфера применения азотной кислоты в настоящее время огромна. Она охватывает многие отрасли промышленности, такие как:
— химическую (изготовление взрывчатых веществ, органических красителей, пластмасс, натрия, калия, пластмасс, некоторых видов кислот, искусственного волокна);
— сельскохозяйственную (производство азотных минеральных удобрений или селитры);
— металлургическую (растворение и травление металлов);
— фармакологическую (входит в состав препаратов по удалению кожных образований);
— ювелирное производство (определение чистоты драгоценных металлов и сплавов);
— военную (входит в состав взрывчатых веществ как нитрующий реагент);
— ракетно-космическую (одна из составляющих ракетного топлива);
— медицину (для прижигания бородавок и других кожных образований).
Азотная кислота
Азотная кислота является одной из самых сильных минеральных кислот, в концентрированном виде выделяет пары желтого цвета с резким запахом. За исключением золота и платины растворяет все металлы.
Применяют азотную кислоту для получения красителей, удобрений, органических нитропродуктов, серной и фосфорной кислот. В результате ожога азотной кислотой образуется сухой струп желто-зеленого цвета.
В промышленности азотную кислоту получают в результате окисления аммиака на платино-родиевых катализаторах.
Чистая азотная кислота впервые была получена действием на селитру концентрированной серной кислоты:
Является одноосновной сильной кислотой, вступает в реакции с основными оксидами, основаниями. С солями реагирует при условии выпадения осадка, выделения газа или образования слабого электролита.
При нагревании азотная кислота распадается. На свету (hv) также происходит подобная реакция, поэтому азотную кислоту следует хранить в темном месте.
Для малоактивных металлов (стоящих в ряду напряжений после водорода) реакция с концентрированной азотной кислотой происходит с образованием нитрата и преимущественно NO2.
С разбавленной азотной кислотой газообразным продуктом преимущественно является NO.
В реакциях с металлами, стоящими левее водорода в ряду напряжений, возможны самые разные газообразные (и не газообразные) продукты: бурый газ NO2, NO, N2O, атмосферный газ N2, NH4NO3.
Помните о закономерности: чем более разбавлена кислота и активен металл, тем сильнее восстанавливается азот. Ниже представлены реакции цинка с азотной кислотой в различных концентрациях.
Посмотрите на таблицу ниже, в которой также отражены изученные нами закономерности.
Концентрированная холодная азотная кислота пассивирует хром, железо, алюминий, никель, свинец и бериллий. Это происходит за счет оксидной пленки, которой покрыты данные металлы.
Al + HNO3(конц.) ⇸ (реакция не идет)
При нагревании или амальгамировании (покрытие ртутью) перечисленных металлов реакция с азотной кислотой идет, так как оксидная пленка на поверхности металлов разрушается.
Получают нитраты в ходе реакции азотной кислоты с металлами, их оксидами и основаниями.
В реакциях с оксидами и основаниями газообразный продукт обычно не выделяется.
Нитрат аммония получают реакция аммиака с азотной кислотой.
Как и для всех солей, из нитратов можно вытеснить металл другим более активным. Соли реагируют с основаниями и кислотами, если в результате реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
Нитраты разлагаются в зависимости от активности металла, входящего в их состав.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Азотная кислота [HNO3]: структура Льюиса / свойства / применение
Это очень агрессивное и токсичное вещество, которое может вызвать серьезные повреждения кожи при использовании без мер предосторожности. Кислота вступает в реакцию с оксидами, гидроксидами и металлами, такими как серебро, медь и железо, образуя нитратные соли.
Обычно азотная кислота, доступная в магазинах, представляет собой 68-процентный водный раствор. Когда ее концентрация (в воде) превышает 86 процентов, она называется дымящейся азотной кислотой. Она хранится в плотно закрытой емкости в сухом, прохладном и хорошо проветриваемом помещении.
Ниже мы рассмотрим, как производится эта кислота, как она выглядит в молекулярном масштабе, каковы ее химические и физические свойства и где она в основном используется.
Азотная кислота HNO3 свойства
Молярная масса: 63,012 г / моль
Внешний вид: Бесцветная или дымящаяся жидкость желто-красного цвета
Запах: неприятно горький или острый, удушающий
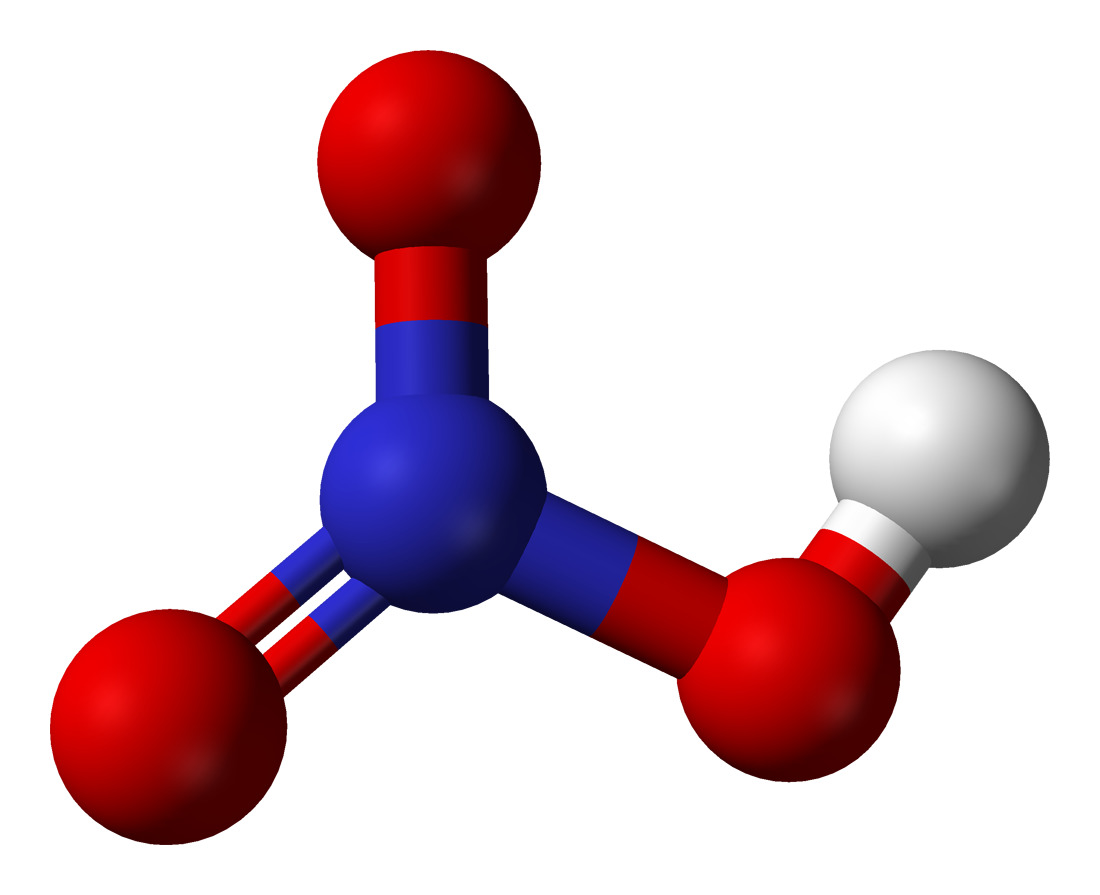
Структура
Поскольку кислород имеет большую тенденцию притягивать к себе общие электроны, чем азот, он несет отрицательный заряд, а атом азота несет положительный заряд.
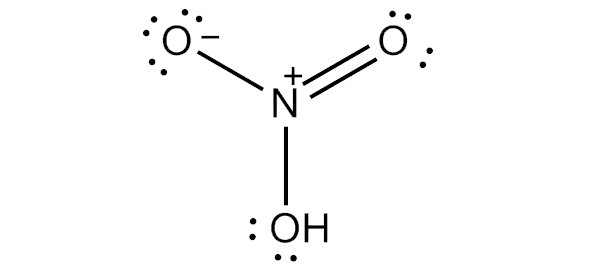
Структура Льюиса
Чтобы нарисовать льюисовскую структуру азотной кислоты, нам нужно подсчитать общее количество валентных электронов в молекуле HNO3.
Это дает нам общее количество валентных электронов (5 + 1 + 18) в одной молекуле HNO3. Поскольку у азота больше валентных электронов, чем у кислорода, мы можем поместить атом азота в центр структуры.
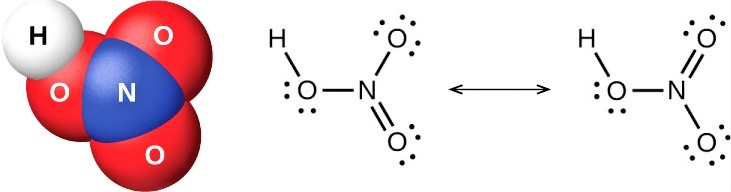
Наконец, нам нужно минимизировать заряды на атомах, чтобы сделать структуру стабильной. Это может быть сделано путем преобразования одинокой пары на одном атоме кислорода в связь. Конечная структура состоит из двух одиночных связей между атомом азота и двумя атомами кислорода, а также двойной связи между атомом азота и оставшимся атомом кислорода.
Есть два правильных способа нарисовать структуру Льюиса HNO3. Таким образом, он имеет две основные формы резонанса. Двунаправленная стрелка на изображении выше указывает на то, что существует более одного способа нарисовать структуру азотной кислоты.
Как она производится?
Для производства HNO3 используются два метода. Первый использует окисление, конденсацию и абсорбцию для синтеза слабой HNO3 с концентрациями от 30 до 70 процентов. Второй метод производит сильную HNO3 (с концентрацией 90 процентов) из слабой HNO3 путем объединения процессов обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты образуется в результате высокотемпературного каталитического окисления аммиака. Это называется процессом Оствальда. Он состоит из трех этапов:
1) Окисление аммиака
Смесь аммиака и воздуха (1:9) окисляется до высокой температуры (750-800 ℃) при прохождении через каталитический преобразователь. Катализатор обычно изготавливается из 90% платины и 10% родиевой сетки. Эта (экзотермическая) реакция приводит к образованию оксида азота и воды в виде пара.
2) Окисление оксида азота
Окись азота, образовавшаяся в предыдущей реакции, окисляется: она некаталитически реагирует с остаточным кислородом с образованием диоксида азота. Это медленная, однородная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низких температурах эта реакция приводит к образованию максимального количества диоксида азота за очень короткое время.
3) Поглощение
В конечной реакции оксид азота поглощается водой. Это дает желаемый продукт (азотную кислоту в разбавленной форме) вместе с оксидом азота. Концентрация HNO 3 зависит от давления, температуры, количества стадий абсорбции, а также от концентрации оксидов азота, поступающих в абсорбер.
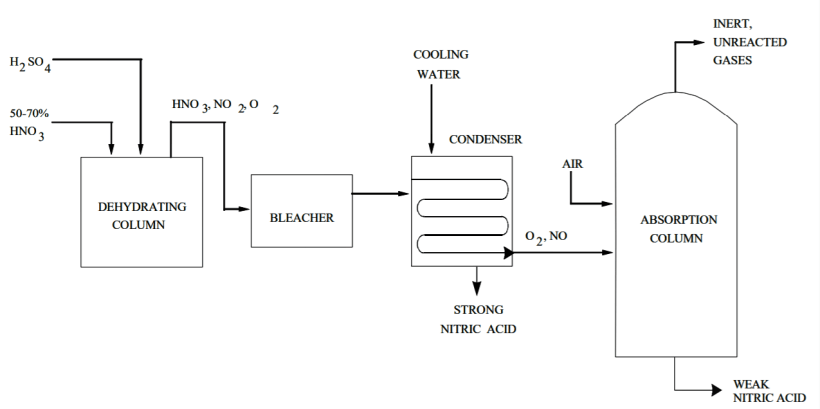
Производство сильной азотной кислоты
Высокопрочная HNO 3 получается путем концентрирования слабой HNO 3 экстрактивной дистилляцией. Дистилляция проводится в присутствии дегидратирующего агента, например 60% серной кислоты.
Процесс протекает следующим образом: сильная серная кислота и слабая азотная кислота попадают в насадочную дегидратирующую колонну при атмосферном давлении. Концентрированная HNO 3 выходит из верхней части колонны в виде 99% пара. Он также состоит из небольшого количества кислорода и оксида азота от диссоциации азотной кислоты.
Кислота проходит через отбеливатель и попадает в систему конденсатора, который отделяет ее от оксида азота и кислорода. Абсорбционная колонна забирает эти побочные продукты и объединяет оксид азота со вспомогательным воздухом для получения диоксида азота. Этот газообразный диоксид азота затем рекуперируется в виде слабой HNO 3, а небольшие непрореагировавшие и инертные газы выбрасываются в атмосферу.
Производство в лаборатории
В лаборатории HNO 3 обычно синтезируется путем термического разложения нитрата меди. Это дает оксид меди, диоксид азота и кислород. Последние два пропускаются через воду для получения азотной кислоты.
А затем реализовать процесс Оствальда
В последние пару десятилетий исследователи разработали электрохимические средства для получения безводной кислоты из концентрированного HNO 3. Этот процесс осуществляется путем регулирования тока электролиза до тех пор, пока не будут получены необходимые продукты.
Свойства
68% раствор HNO 3 имеет температуру кипения 120,5 °C при давлении 1 атм. С другой стороны, чистая HNO 3 кипит при 83 °C. При комнатной температуре эта концентрированная форма выглядит как бесцветная жидкость.
Поскольку азотная кислота имеет свойство разлагаться на открытом воздухе, ее хранят в стеклянных бутылках.
Оксиды азота, образующиеся в результате реакции разложения, полностью или частично растворяются в кислоте, вызывая незначительные изменения давления пара над жидкостью. Когда он остается растворенным, он дает кислотно-желтый цвет или красный при более высоких температурах.
Концентрированная азотная кислота выделяет белые пары при контакте с воздухом, в то время как кислота, растворенная в диоксиде азота, образует красновато-коричневые пары.
По концентрации сильную HNO 3 можно разделить на две группы: красная и белая дымящаяся азотная кислота. Первый содержит 84% азотной кислоты, 13% тетроксида диазота и 1-2% воды. Напротив, белая дымящаяся азотная кислота содержит не более 2% воды и очень небольшое количество растворенного диоксида азота (0,5%).
HNO3 с растворенным оксидом азота
Среди нескольких важных реакций HNO3 можно выделить следующие –
А так как это сильный окислитель, то он бурно реагирует с различными неметаллическими веществами. Продукты таких взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Области применения
Химические и физические свойства азотной кислоты делают ее ценным веществом. Она имеет несколько различных применений в различных областях, особенно в химической и фармацевтической промышленности.
Удобрения: Почти 80% производимой азотной кислоты используется для производства удобрений. Точнее, она используется для производства аммиачной селитры (NH 4 NO 3) и кальций-аммиачной селитры, которые находят применение в качестве удобрений.
Красители и пластмассы: Нитрат кальция и аммония используется в некоторых упаковках со льдом/гелем в качестве альтернативы аммиачной селитре. Она также используется для производства химикатов и растворов, которые используются в производстве красителей и пластмасс.
Ракетное топливо: красная и белая дымящаяся азотная кислота используется в жидкостных ракетах в качестве окислителя. Во время Второй мировой войны немецкие военные использовали дымящуюся красную азотную кислоту в нескольких ракетах.
Деревообработка: Очень слабая HNO3 (с концентрацией 10%) используется для искусственного старения древесины сосны и клена. Придает дереву винтажный вид с масляной отделкой.
Другие применения: слегка концентрированный раствор под названием Nital используется для травления металла, чтобы выявить его структуру на микроуровне. Рефлюксная азотная кислота используется в процессах очистки углеродных нанотрубок. В электрохимии HNO3 используется в качестве химического легирующего агента для органических полупроводников.
Вопросы и ответы
Проводит ли HNO3 электричество?
Как и другие сильные кислоты, азотная кислота является хорошим проводником электричества. Исследования показывают, что обработка материала этой кислотой может улучшить его электропроводность до 200 раз.
Растворяет ли HNO3 золото?
Азотная кислота не реагирует с некоторыми драгоценными металлами, такими как металлы платиновой группы и чистое золото. Однако она может растворять некоторые сплавы золота, содержащие менее благородные металлы, такие как серебро и медь. Цветное золото, например, растворяется в азотной кислоте и меняет цвет своей поверхности.
Хотя чистое золото не проявляет никакого эффекта при контакте с азотной кислотой, оно реагирует с царской водкой, смесью азотной и соляной кислот, оптимально в молярном соотношении 1:3. Некоторые ювелирные магазины используют азотную кислоту как дешевое средство для быстрого обнаружения сплавов с низким содержанием золота (менее 14 карат).
Как нейтрализуется HNO 3?
При более высоких концентрациях выделение азотной кислоты может быть весьма значительным, и поэтому необходима хорошая вентиляция. Ее можно нейтрализовать любым неорганическим основанием, например, гидроксидом натрия или известью.
Такие реакции нейтрализации выделяют много тепла. Например, нейтрализация 10% раствора азотной кислоты приведет к повышению температуры на 20 °C, а нейтрализация 70% раствора приведет к повышению температуры на 120 °C, что достаточно для того, чтобы вызвать паровые взрывы.